Metan
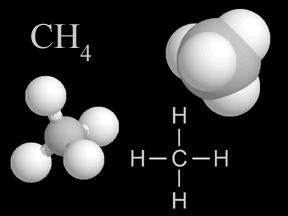
Metanul (CH4) este o hidrocarbură saturată, componentul principal al gazelor naturale.
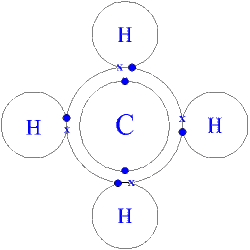
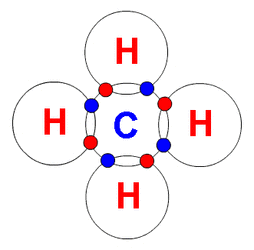
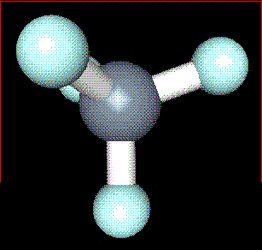
Generalităţi Metanul a fost descoperit de A.Volta în 1778 în mâlul bălţilor, din această cauză fiind numit şi gaz de baltă. Metanul este capul de serie a alcanilor, o hidrocarbură saturată aciclică, în care atomul de carbon este hibridizat sp3, având o geometrie tetraedrică de hidrocarburi parafinice.
Răspândire Metanul se găseşte sub formă de zăcăminte naturale în stare destul de pură, la noi în ţară puritatea metanului fiind de 99%, însă se poate întâlni şi în minele de cărbuni unde în amestec cu aerul formează amestecul exploziv numit gaz grizzu (responsabil de exploziile miniere).
Metode de sinteză
Fermentaţia anaerobă Metanul este produs prin fermentarea resturilor vegetale sau animale mai ales pe fundul bălţilor, metoda putînd fi folosită şi in cazul epurărilor apelor reziduale din marile oraşe şi nu numai.
Gazul de iluminat În gazul de iluminat obţinut prin distilarea uscată a huilei există un procent de circa 20-30%.
Metode de laborator
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
CH3-COONa + NaOH = CH4 + Na2CO3
Proprietăţi fizico-chimice Metanul este un gaz incolor, inodor, mai uşor decît aerul. Este foarte puţin solubil în apă (sub 1%), dar solubil în alcool şi eter. Arde cu flacără puţin luminoasă, cu degajare mare de caldură (8560kcal/m3). Amestecul de metan şi oxigen (sau metan şi aer) explodează în prezenţa unei scântei. Aşa se explică exploziile care se produc uneori în minele de cărbuni, unde se găsesc cantităţi însemnate de metan sub formă de gaz grizzu. Acesta are o comportare deosebită faţă de celelalte hidrocarburi, datorita faptului că legătura covalentă existentă în moleculă este foarte stabilă, iar acest fapt influenţează comportamnetul său chimic. Prin arderea completă a metanului cu cantităţi insuficiente de aer, în instalaţii speciale, se obţine „negrul de fum” -- o sursă importantă pentru sintezele chimice (în special cele pentru fabricarea cauciucului). Prin trecerea metanului împreună cu vapori de apă peste catalizatori de aluminiu la o temperatură de circa 850 °C se obţine un amestec de oxid de carbon şi hidrogen care poate fi folosit drept „gaz de sinteză”:
CH4 + H20 = CO + 3H2 Acest gaz de sinteză trecut peste un catalizator de fier la 450 °C suferă o transformare la nivelul oxidului de carbon, acesta fiind transformat în dioxid de carbon
Atunci cînd catalizatorii nu sunt prezenţi, metanul este stabil pînă la circa 900 °C. Prin trecerea metanului prin tuburi de cuarţ la 1000-1200 °C se formează, cu randamente relativ mici, acetilenă, etenă, butadienă, dar şi hidrocarburi aromatice de tipul benzenului, xilenuluin antracenului, etc. Ca orice hidrocarbură saturată, metanul poate suferi reacţii de substituţie, reacţiile de halogenare (clorurare) ale metanului fiind cele mai reprezentative din acest punct de vedere. Acestea conduc în final la o compuşi mono-, di-, tri-tetra substituţi, însă mai poate suferi şi reacţii de amonooxidare (tratarea cu amoniac si oxigen, respectiv aer), în urma cărora se formează acid cianhidric (cianurile alcaline, diferite produse intermediare pentru industria materialelor plastice, a fibrelor sintetice, a cauciucului sintetic), sulfura de carbon CS2 (prin tratare cu sulf la 600-700 °C, în prezenţa catalizatorilor), nitrarea (se obţine nitrometan, bun dizolvant). Metanul poate suferi şi o oxidare catalitică la temperaturi de 600-700 °C, în urma căreia rezultă formaldehida.
Generalităţi Metanul a fost descoperit de A.Volta în 1778 în mâlul bălţilor, din această cauză fiind numit şi gaz de baltă. Metanul este capul de serie a alcanilor, o hidrocarbură saturată aciclică, în care atomul de carbon este hibridizat sp3, având o geometrie tetraedrică de hidrocarburi parafinice.
Răspândire Metanul se găseşte sub formă de zăcăminte naturale în stare destul de pură, la noi în ţară puritatea metanului fiind de 99%, însă se poate întâlni şi în minele de cărbuni unde în amestec cu aerul formează amestecul exploziv numit gaz grizzu (responsabil de exploziile miniere).
Metode de sinteză
Fermentaţia anaerobă Metanul este produs prin fermentarea resturilor vegetale sau animale mai ales pe fundul bălţilor, metoda putînd fi folosită şi in cazul epurărilor apelor reziduale din marile oraşe şi nu numai.
Gazul de iluminat În gazul de iluminat obţinut prin distilarea uscată a huilei există un procent de circa 20-30%.
Metode de laborator
- Metoda Moissan
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
- Metoda Dumas
CH3-COONa + NaOH = CH4 + Na2CO3
Proprietăţi fizico-chimice Metanul este un gaz incolor, inodor, mai uşor decît aerul. Este foarte puţin solubil în apă (sub 1%), dar solubil în alcool şi eter. Arde cu flacără puţin luminoasă, cu degajare mare de caldură (8560kcal/m3). Amestecul de metan şi oxigen (sau metan şi aer) explodează în prezenţa unei scântei. Aşa se explică exploziile care se produc uneori în minele de cărbuni, unde se găsesc cantităţi însemnate de metan sub formă de gaz grizzu. Acesta are o comportare deosebită faţă de celelalte hidrocarburi, datorita faptului că legătura covalentă existentă în moleculă este foarte stabilă, iar acest fapt influenţează comportamnetul său chimic. Prin arderea completă a metanului cu cantităţi insuficiente de aer, în instalaţii speciale, se obţine „negrul de fum” -- o sursă importantă pentru sintezele chimice (în special cele pentru fabricarea cauciucului). Prin trecerea metanului împreună cu vapori de apă peste catalizatori de aluminiu la o temperatură de circa 850 °C se obţine un amestec de oxid de carbon şi hidrogen care poate fi folosit drept „gaz de sinteză”:
CH4 + H20 = CO + 3H2 Acest gaz de sinteză trecut peste un catalizator de fier la 450 °C suferă o transformare la nivelul oxidului de carbon, acesta fiind transformat în dioxid de carbon
Atunci cînd catalizatorii nu sunt prezenţi, metanul este stabil pînă la circa 900 °C. Prin trecerea metanului prin tuburi de cuarţ la 1000-1200 °C se formează, cu randamente relativ mici, acetilenă, etenă, butadienă, dar şi hidrocarburi aromatice de tipul benzenului, xilenuluin antracenului, etc. Ca orice hidrocarbură saturată, metanul poate suferi reacţii de substituţie, reacţiile de halogenare (clorurare) ale metanului fiind cele mai reprezentative din acest punct de vedere. Acestea conduc în final la o compuşi mono-, di-, tri-tetra substituţi, însă mai poate suferi şi reacţii de amonooxidare (tratarea cu amoniac si oxigen, respectiv aer), în urma cărora se formează acid cianhidric (cianurile alcaline, diferite produse intermediare pentru industria materialelor plastice, a fibrelor sintetice, a cauciucului sintetic), sulfura de carbon CS2 (prin tratare cu sulf la 600-700 °C, în prezenţa catalizatorilor), nitrarea (se obţine nitrometan, bun dizolvant). Metanul poate suferi şi o oxidare catalitică la temperaturi de 600-700 °C, în urma căreia rezultă formaldehida.